Nowy punkt wyjścia dla standardu branżowego
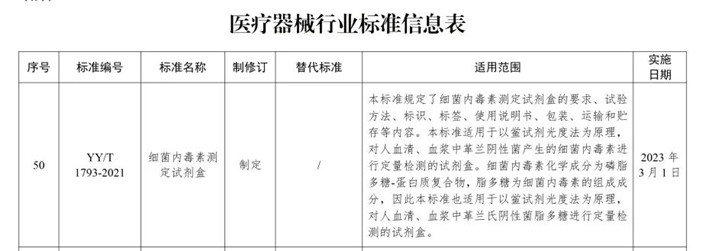
Po YY/T 1729-2020 „Zestaw do oznaczania grzybów (1-3)-β-D glukan”, YY/T 1793-2021 „Zestaw do oznaczania endotoksyn bakteryjnych” opracowany przez Genobio zostanie wydany w 2021 r. 9 września został zatwierdzony przez Państwową Agencję Leków i oficjalnie wydany.Standard zostanie formalnie wdrożony 1 marca 2023 roku.

Przygotowanie standardu „Bacterial Endotoxin Test Kit” zostało zorganizowane przez Krajowe Medyczne Laboratorium Kliniczne oraz Komitet Techniczny Standaryzacji Systemów Diagnostyki In Vitro (TC136) i zostało oficjalnie rozpoczęte w kwietniu 2019 r. Z Genobio Pharmaceutical Co., Ltd. jako pierwszy kreślarz, zjednoczony z Pekińskim Instytutem Kontroli Urządzeń Medycznych, Pekińskim Centrum Oceny Technologii Urządzeń Medycznych, Szanghajskim Centrum Badań Klinicznych, Beijing Jinshanchuan Technology Development Co., Ltd. (spółką zależną będącą w całości własnością) i wieloma innymi jednostkami wspólnie opracowanymi i sformułowanymi.
Jako wiodąca firma w krajowej branży szybkiej kontroli grzybów/bakteryjnych, Genobio jest zaangażowane w ciągłe podnoszenie standardów produktów.Od ponad 20 lat kierujemy się wiodącą w branży pozycją i standaryzowanym rynkiem jako naszym przewodnikiem, nieustannie idąc z duchem czasu, dążąc do perfekcji i nieustannie dążąc do doskonałości.Upowszechnienie tego standardu może skutecznie ujednolicić jakość produktów w branży i wzmocnić reputację branży badań endotoksyn bakteryjnych w całej dziedzinie diagnostyki in vitro.
Zestaw do wykrywania endotoksyn bakteryjnych (metoda chromogenna)
Genobio będzie nadal aktywnie wdrażać standardowe prace reklamowe i wdrożeniowe oraz opowiadać się za poprawą jakości produktów w branży.Jednocześnie zostanie zorganizowany personel techniczny do prowadzenia standardowych szkoleń promocyjnych i wdrożeniowych dla użytkowników klinicznych i laboratoryjnych w głównych szpitalach oraz „wysyłania standardów do drzwi”.
W przyszłości Genobio będzie nadal wykorzystywać zalety techniczne lidera w branży, podejmować inicjatywę uczestniczenia w opracowywaniu innych powiązanych standardów produktów, wnosić własne siły w proces standaryzacji branży diagnostyki in vitro oraz eskortować bezpieczny rozwój przemysł medyczny mojego kraju!
Czas publikacji: 10 września-2021
